人体类器官:药物研发的 3D “迷你器官” 革命
来源:生物制品圈 2025-12-02 09:09
作为由干细胞培育而成的 3D 结构,类器官能高度复刻人体组织的关键特征和功能,比传统 2D 细胞系、动物模型更贴近人类生理。
你能想象在实验室里培育出一颗微型肝脏、一小块肠道,甚至是迷你大脑吗?这不是科幻情节,而是人体类器官技术带来的现实。作为由干细胞培育而成的 3D 结构,类器官能高度复刻人体组织的关键特征和功能,比传统 2D 细胞系、动物模型更贴近人类生理。本文将从类器官的诞生、在疾病建模与药物研发中的应用,到目前面临的挑战,为你揭开这项颠覆性技术的神秘面纱,看看它如何成为药物发现的 “新引擎”。

一、从 Flat 到 3D:类器官为何能颠覆传统模型?
在药物研发的漫长历史中,2D 细胞系和动物模型曾是科研人员的 “左膀右臂”。细胞系培养简单、成本低,却因生长在塑料表面,失去了真实组织的结构和细胞多样性;动物模型能模拟完整生物体的反应,但物种差异常常让实验结果无法直接套用到人类身上,还面临伦理争议。
而类器官的出现,恰好弥补了这些短板。它是由干细胞(包括多能干细胞和组织干细胞)在体外培育出的 3D 组织模型,能精准复刻对应器官的架构和功能 —— 比如肠道类器官会形成隐窝 - 绒毛结构,大脑类器官能出现神经元的分层排布。更重要的是,类器官保留了人体组织的复杂性和异质性,就像一个 “缩小版” 的人体器官,让科研人员能在实验室里直接研究人类的生理和病理过程。
对比传统模型,类器官的优势十分明显:生理相关性高、能实现中高通量筛选、成本和时间投入更适中,尽管目前监管认可度还在提升阶段,但已是药物研发领域的 “潜力股”(见表 1)。
表 1 | 人体类器官与传统临床前模型的对比
二、类器官的 “成长记”:两种核心培育路径
培育类器官主要有两条核心路径,分别依托多能干细胞(PS 细胞)和组织干细胞(TSC),不同路径各有特点,适用于不同的研究场景(见图 1)。
多能干细胞培育路径像是 “复刻胚胎发育”:先将体细胞重编程为诱导多能干细胞(iPS 细胞),再通过模拟胚胎发育的信号环境,一步步引导 iPS 细胞分化,最终形成特定器官的类器官。这个过程需要数周甚至数月,能培育出大脑、视网膜、心脏等难以从成体组织获取的类器官,比如科学家已成功培育出能模拟视网膜结构的类器官,为眼科疾病研究提供了新工具。
组织干细胞培育路径则更 “直接”:从患者的活检样本中分离出组织干细胞,直接在 3D 基质(如 Matrigel)中培养,利用特定生长因子支持干细胞的扩增和分化。这种方法耗时更短(数天到数周),能快速培育出肠道、肝脏、肺等组织的类器官,还能保留患者的个体特征,成为个性化医疗的重要工具。
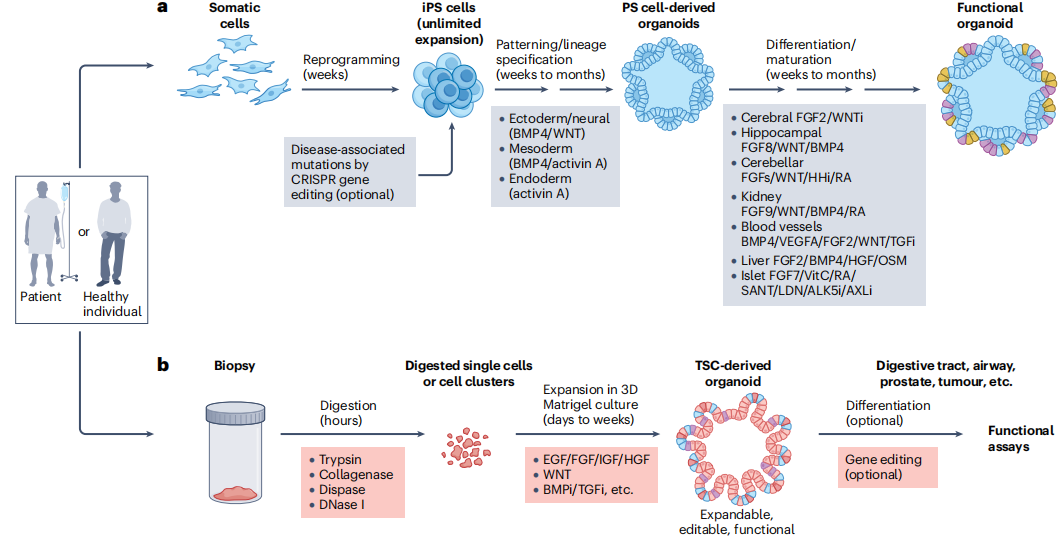
注:a 为诱导多能干细胞来源类器官的生成流程,b 为组织干细胞来源类器官的生成流程
三、类器官的 “超能力”:从疾病建模到药物研发
(一)解锁疾病的 “密码”:精准模拟人类疾病
类器官就像一个 “疾病模拟器”,能精准复刻遗传疾病、癌症、感染性疾病等多种病症的特征,让科研人员看清疾病的发生机制。
不同类型的类器官能模拟的疾病各有侧重,从遗传疾病到感染性疾病,几乎覆盖了人类常见的病症领域(见图 2)。
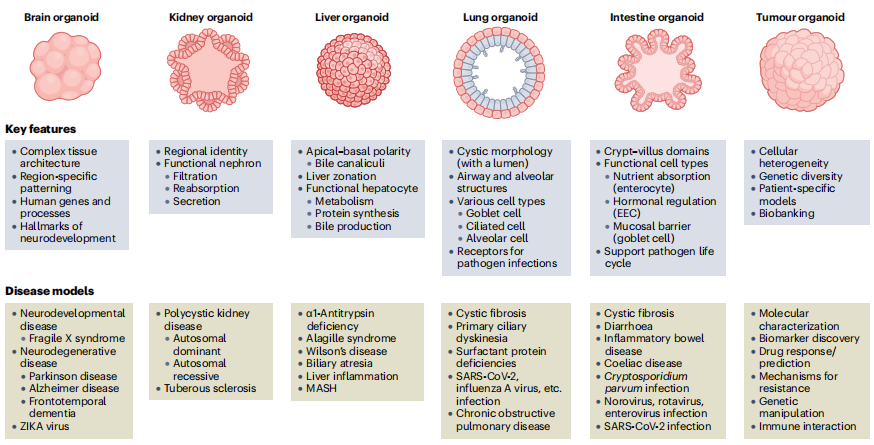
在遗传疾病研究中,囊性纤维化(CF)是典型案例。患者的肠道类器官在加入福斯高林后无法像健康类器官那样肿胀,而通过 CRISPR 修正基因突变或使用有效的 CFTR 调节剂,又能恢复肿胀反应。这种简单的 “肿胀实验” 不仅能验证药物效果,还能和患者的临床指标挂钩,成为个性化治疗的依据。帕金森病、阿尔茨海默病等神经系统疾病,也能通过大脑类器官模拟出神经元损伤、蛋白聚集等病理特征,为研究疾病根源提供了新思路。
在癌症研究中,患者来源的肿瘤类器官(PDTO)堪称 “宝藏模型”。它能保留肿瘤的遗传特征和异质性,从患者的肿瘤组织中培育出的 PDTO,就像 “活体肿瘤样本”,可用于测试不同药物的疗效,预测患者的治疗反应。目前,胃癌、结直肠癌、乳腺癌等多种癌症的 PDTO 生物样本库已建立,为抗癌药物的筛选和个性化治疗提供了支撑。
在感染性疾病研究中,类器官更是解决了传统模型的 “痛点”。比如诺如病毒无法在常规细胞系中复制,而肠道类器官却能支持其完整的生命周期;新冠病毒(SARS-CoV-2)能在呼吸道类器官中感染并复制,让科研人员快速筛选出有效的抗病毒药物,还发现羟氯喹对新冠病毒并无抑制作用,纠正了早期的研究误区。
(二)药物研发的 “试金石”:筛选与安全评估
类器官不仅能模拟疾病,还能成为药物研发的 “试金石”,贯穿药物筛选、安全性评估的全流程。
在药物筛选中,类器官能实现中高通量的化合物测试。比如在多囊肾病的研究中,科研人员利用可规模化的肾脏类器官进行高通量筛选,发现了喹唑啉等能抑制囊肿生长的潜在药物;在 Zika 病毒研究中,通过大脑类器官筛选,找到了能挽救病毒诱导的小头畸形的药物。
在药物安全性评估中,类器官能精准预测药物对肝脏、肾脏、肠道等器官的毒性。肝脏是药物代谢的核心器官,也是药物毒性的 “重灾区”,而肝脏类器官能模拟药物诱导的肝损伤,比传统的肝癌细胞系更准确;肾脏类器官能检测出顺铂、庆大霉素等药物的肾毒性,通过肾损伤标志物的表达变化,提前预警药物的安全风险(见表 3)。
表3 | 类器官在药物安全性评估中的应用
四、前路漫漫:类器官面临的挑战与突破
尽管类器官潜力巨大,目前仍面临不少挑战。首先,类器官缺乏血管、免疫细胞、神经等关键组织成分,无法完全模拟体内的微环境;其次,类器官的培养存在批次差异,标准化和可重复性有待提升;此外,类器官的监管认可度还在逐步建立,需要更多的临床数据验证其预测价值。
不过,科研人员已经在寻找解决方案:通过类器官芯片(Organoid-on-a-chip)技术,将类器官与微流控系统结合,模拟体内的流体流动和组织间的相互作用;通过3D 生物打印,构建更接近体内结构的类器官;还能将免疫细胞、血管内皮细胞与类器官共培养,提升其复杂性(见图 3)。同时,自动化培养和高通量筛选平台的发展,也让类器官的规模化应用成为可能。
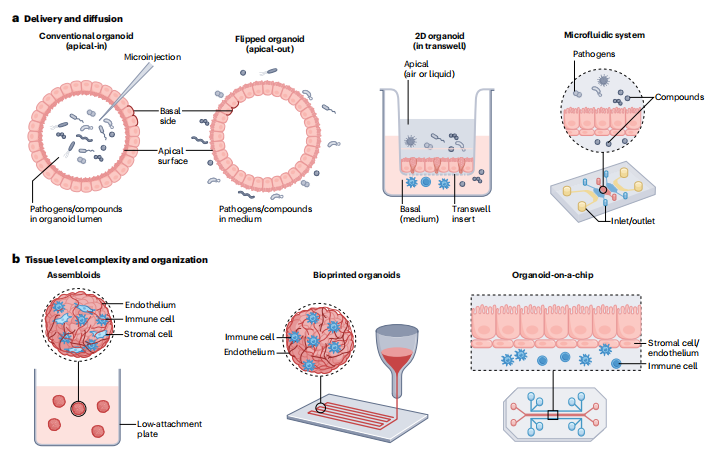
注:a 为物质递送和扩散策略,b 为具有更高组织复杂性和组织排布的先进类器官模型
科研人员开发出了一套完整的自动化高通量药物筛选流程,从类器官的精准培养到药物效果的自动化分析,都有对应的技术手段支撑(见图 4)。
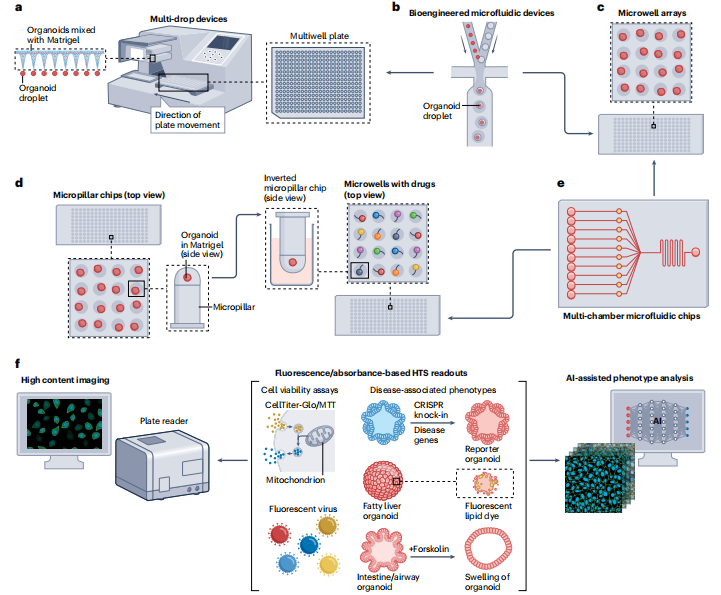
五、结语:类器官的未来,不止于药物研发
从实验室里的 “迷你器官” 到药物研发的核心工具,类器官正在改写生物医药研究的规则。它不仅能让药物研发更高效、更精准,还能推动个性化医疗的发展 —— 未来,或许每个患者都能拥有专属的类器官模型,为治疗方案的选择提供定制化参考。
当然,类器官的发展还需要攻克技术、监管等多重难关,但随着研究的深入,这颗生物医药领域的 “新星”,终将在疾病研究、药物研发、再生医学等领域绽放更大的光芒。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


